东京工业大学研究人员最近的一项研究发现,形成生物膜的细菌大肠杆菌牢固地粘附在疏水性和亲水性蛋白质吸附自组装单层(SAM)上,而对亲水性抗蛋白质SAM的粘附力较弱。这些关于表面化学如何影响细菌细胞粘附以及生物膜形成的发现可以为生物医学和工业设备的抗菌表面和抗生物污垢涂层的开发提供信息。
细菌生物膜就像一把双刃剑。一方面,它们已被证明对发电和降解水和土壤中的有毒物质很有价值,但另一方面,当它们在饮用水管内、隐形眼镜和生物医学设备上形成时,会造成麻烦。为了形成生物膜,细菌细胞首先通过弱的可逆键附着在材料表面。一旦这些键成熟,细胞就会释放聚合物质,从而形成稳定且不可逆的生物膜。
解码不可逆生物膜形成的潜在机制及其与表面化学的关系是解锁生物膜预防技术的关键。多年来,科学家们提出了各种技术来缩小细菌细胞倾向于粘附的表面类型。不幸的是,表面化学和表面形貌对生物膜形成的影响仍然不明确。
在此背景下,由日本东京工业大学(TokyoTech)副教授TomohiroHayashi领导的一组研究人员着手解决这一知识差距。在最近发表在ACSAppliedBioMaterials上的一项突破中,该团队使用光学显微镜和一种称为“具有能量耗散(QCM-D)监测功能的石英晶体微天平。”
Hayashi博士解释说:“我们选择QCM-D是因为它是一种超灵敏设备,可以使用声波监测小至纳克的吸附质量。同样,选择具有可调终端基团的SAMs在原子平面QCM传感器上进行功能化,因为它们可以帮助解开缠结底物地形表面化学对细菌附着的影响。”
研究表明,传统的质量载荷理论无法完全解释细菌附着在表面上的现象。这是因为该理论没有解释由额外质量吸附到表面引起的共振频率(f)的正移和负移,这会显着影响生物膜的形成。通过耦合谐振器模型考虑到这种复杂行为,该团队检查了QCM传感器振荡的f和能量耗散(D)的变化,并评估了它们对具有不同功能的SAM表面的细菌附着和粘弹性的影响。
显微镜图像和QCM-D数据显示大肠杆菌牢固地粘附在疏水性(甲基终止)和亲水性蛋白质吸附(胺基和羧基终止)SAM上(图1a和b),形成致密的细菌膜。相比之下,它弱附着于亲水性抗蛋白SAM(图1c),例如低聚物(乙二醇)和磺基甜菜碱,并形成稀疏和耗散的生物膜。
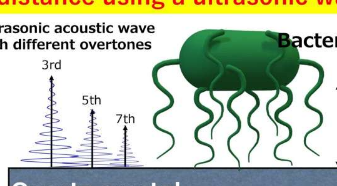
该团队还观察到亲水性抗蛋白SAM的正f偏移,这可能是由于大肠杆菌的细菌附属物不仅在开始与表面接触和结合方面发挥作用,而且在与表面形成弹性弹簧状连接方面也发挥了作用。表面。此外,通过根据每个泛音处的不同声波穿透深度来估计细菌细胞体与不同SAM表面的距离(图2),他们提供了一种可能的解释,说明为什么细菌细胞强烈地粘附在某些表面上而弱地粘附在其他表面上。
这些有价值的见解可以帮助识别生物膜污染概率更高的表面,并为抗污染表面铺平道路。“我们的研究可以作为实用指南,用于确定哪些表面容易发生细菌污染,以及设计预防策略,例如抗细菌表面和抗生物污染涂层,”Hayashi博士总结道。
