剧烈运动后疼痛的肌肉通常不会持续很长时间,这要归功于干细胞沿着肌肉内的“胶原蛋白高速公路”冲向受伤部位并修复受损组织。但如果细胞无法到达目的地,受损组织就无法再生。随着时间的推移,它会完全崩溃并停止工作。
在最近发表在npjRegenerativeMedicine上的一项研究中,由加州大学洛杉矶分校的生物化学家领导的一组研究人员首次表明,携带这些愈合细胞的胶原蛋白框架的疤痕会导致肌肉在杜氏肌营养不良症中逐渐停止工作。在老鼠身上的发现阐明了干细胞疗法对这种疾病无效的一个原因:细胞根本无法到达最需要它们的地方。
杜氏肌营养不良症是最常见也是最严重的遗传性肌营养不良症之一。这种通常影响男孩的肌肉萎缩症从童年开始,不可避免地以死亡告终,因为为心脏、肺和其他重要器官提供动力的肌肉出现衰竭。它是由抗肌萎缩蛋白基因突变引起的,该蛋白调节肌肉细胞的组织。在健康人体内,肌营养不良蛋白帮助称为肌纤维的肌肉细胞束附着在胶原蛋白框架上——细胞外基质赋予肌肉形状,将它们固定在一起,并为干细胞提供修复和再生受损组织的“高速公路”。
加州大学洛杉矶分校综合生物学和生理学教授RachelleCrosbie正在寻找治疗Duchenne肌营养不良症的方法,她怀疑这种突变引起的功能障碍导致细胞外基质形成疤痕和硬化,这一过程称为纤维化。
Crosbie和Crosbie实验室的博士后研究员KristenStearns-Reider设计了一个独特的实验来找出答案。利用加州大学洛杉矶分校加州纳米系统研究所的设施,他们设计了一种方法来“清洗”健康小鼠和杜氏肌营养不良症小鼠胶原蛋白细胞外基质中的所有细胞。
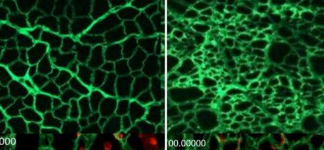
在显微镜下,Crosbie称之为“肌支架”的两种无细胞基质看起来非常不同:健康的看起来像精致的蕾丝,而Duchenne的看起来更像一块致密的海绵。
接下来,研究人员将干细胞植入每个肌支架中,并观察细胞试图生长肌肉组织的过程。肌肉干细胞在肌支架上的生长与它们在健康和患病肌肉中的生长完全相同:在健康的花边肌支架中,细胞沿着光滑的线迁移并沉积在均匀间隔的孔中。然而,Duchenne肌支架的凹凸不平、增厚的表面使行进变得困难,并设置了路障,导致细胞堆积成团;细胞受到压力,无法有效进展。
“就像郊区通勤者一样,常驻干细胞生活在肌纤维的外围,沿着肌纤维移动到受损区域并使肌肉再生。细胞外基质是它们使用的高速公路。”克罗斯比说。“这就像平时开车上班和高速公路发生山体滑坡那天的区别。”
Crosbie说,这是科学家首次对纤维化肌支架中的活细胞进行成像,具体揭示了纤维化如何破坏细胞行为。
当干细胞附着在健康支架上时,细而柔软的线也会轻微变形,这是肌肉组织成功发育的关键变形。干细胞无法使Duchenne支架的厚而硬的纤维变形。在Duchenne支架上生长的组织显示大块肌纤维散布着更大的胶原蛋白块,而不是健康样本中均匀分布的肌纤维。
然后,研究小组在杜氏肌支架上测试了细胞行为,该支架是使用一种名为sarcospan的治疗性蛋白质创建的,已知这种蛋白质可以稳定细胞外基质。一旦sarcospan最大限度地减少了纤维化疤痕的形成,干细胞功能就会得到改善。
“结果非常清楚为什么干细胞疗法对杜氏肌营养不良症具有挑战性,”克罗斯比说。“找到预防或减少细胞外基质疤痕形成的方法可以使它们更有效。”
这些肌支架为研究干细胞-细胞外基质相互作用、干细胞生态位形成、影响干细胞行为的微环境、肌肉成熟和疾病建模提供了多种广泛的可能性,该研究的合著者、加州大学洛杉矶分校博士后研究员MichaelHicks和AprilPyle说,加州大学洛杉矶分校微生物学、免疫学和分子遗传学教授。
Crosbie还指出,由于新方法只需要非常小的样本,因此这些研究可能会扩展到包括个体患者,使用肌肉活检组织在治疗前研究治疗,并确定更可能有效的治疗。
