中国科学技术大学梁浩军教授和包建强研究员领导的研究小组提出了一种新型功能性双链DNA(dsDNA)供体,大大提高了基因敲入的效率。
他们的研究题为“使用CRISPR/Cas9将大DNA序列与3'-突出dsDNA供体进行高效精确整合”,于2023年5月22日发表在《美国国家科学院院刊》(PNAS)上。
成簇规则间隔短回文重复(CRISPR)彻底改变了用于研究和基因治疗目的的基因组操作,它依赖于同源定向修复(HDR)途径,其中涉及具有同源臂的外源供体模板,以实现精确的基因敲入。然而,当使用基因大小的DNA供体时,HDR途径的效率会显着降低。
目前提高基因敲入效率的方法,例如化学修饰或供体与CRISPR系统的共价连接,存在操作困难和高成本。因此,迫切需要进一步优化基因敲入供体,以促进CRISPR/Cas9介导的基因敲入在生命科学和临床治疗中的应用。
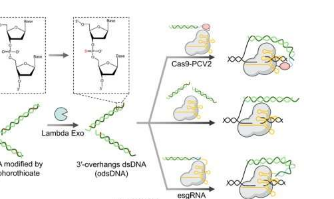
针对这一需求,梁教授课题组对单链DNA(ssDNA)和双链DNA(dsDNA)敲入供体的机制进行了广泛的研究。利用他们在核酸化学方面的专业知识,他们将ssDNA和dsDNA整合到单个供体中,从而设计出具有3'突出端(odsDNA)的新型dsDNA结构。然后将该odsDNA用作CRISPR/Cas9介导的大片段基因敲入的供体,称为LOCK(具有3'-突出端的长dsDNA介导的CRISPR敲入)。
该研究介绍了一种经济且通用的方法来制备具有任意3'突出长度的odsDNA供体。这一最新突破建立在梁教授研究组前期基因编辑成果的基础上。他们之前利用化学修饰的dsDNA供体5'端提高了基因敲入效率,并开发了RNA介导的CRISPR-dCas9转录调控系统。然后使用硫代磷酸酯修饰的引物通过PCR扩增获得所需的基因序列。随后用Lambda核酸外切酶消化产生具有3'突出端的odsDNA。
基因大小的DNA供体(1.1kb和2.5kb)之间的比较表明,odsDNA显着提高了靶向精确整合效率,与传统dsDNA供体相比,实现了高达4.3倍的增强。此外,odsDNA在哺乳动物细胞的多个基因组位点上保持较低的插入缺失率和脱靶事件。通过将3'-单链突出端与连接技术相结合,与dsDNA供体相比,敲入效率提高了5.2倍。
LOCK策略在基因敲入方面展现出显着的优势,具有替代ssDNA或dsDNA供体的潜力,实现了以前无法实现的大片段基因敲入。
