p38蛋白调节多种细胞功能,并与慢性炎症、免疫紊乱或癌症等疾病相关。迄今为止,很难找到用于临床实践的p38抑制剂,因为候选药物会产生毒性作用,妨碍其以足够的治疗剂量给药。
由巴塞罗那IRB的ÁngelR.Nebreda博士、MaríaJ.Macías博士和ModestoOrozco博士领导的多学科团队开发了一种新型p38抑制剂,该抑制剂优先损害该蛋白质的其中一个激活途径。特别是,这些抑制剂可阻断p38的自激活(或自磷酸化),但允许其继续被其他机制激活。
这种选择性抑制使p38蛋白能够发挥其许多正常功能,从而有可能减少与其完全抑制相关的副作用。
具体来说,新化合物阻断的途径涉及因缺乏血液供应而导致的心肌细胞死亡以及心肌梗塞后发生的随后的恢复。
p38自我激活途径也可能与某些抗肿瘤化疗药物引起的心脏损伤有关。
ICREA研究员兼信号与细胞负责人Nebreda博士表示:“选择性抑制像p38这样重要且用途广泛的蛋白质的一些功能是一种创新方法,为开发具有治疗潜力的新化合物铺平了道路。”巴塞罗那IRB的自行车实验室。
计算技术被用来预测蛋白质行为——这项技术由Orozco博士的团队和NostrumBiodiscovery开发。NostrumBiodiscovery是巴塞罗那超级计算中心(BSC-CNS)、巴塞罗那IRB、加泰罗尼亚研究与高级研究所(ICREA)和巴塞罗那大学(UB)的联合子公司;并与IRB巴塞罗那合作执行药物发现过程。特别是,NostrumBiodiscovery进行了分层虚拟筛选和计算机命中优化研究,这对于鉴定能够抑制p38a自磷酸化的化合物至关重要。
为了验证和表征这些抑制剂,Nebreda博士的团队进行了广泛的生化测定,分析了100多种化合物。
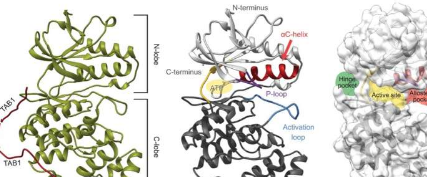
此外,由Macías博士领导的小组与JoanPous博士(来自IRB巴塞罗那-CSICX射线平台)合作开展的结构生物学技术揭示了抑制剂如何附着到p38的结构上。蛋白质从而揭示了它们的作用机制。
“我们发现的化合物类型非常特殊。它们与ATP分子竞争结合p38的活性中心,但它们没有很高的亲和力。因此,一旦蛋白质被外部因素激活,ATP取代了抑制剂,p38可以发挥其正常功能,”该研究的第一作者LorenaGonzález博士解释道,她在巴塞罗那IRB的论文中开展了这个项目。
该团队已开始与希伯伦山谷研究所(VHIR)心血管疾病专家AntonioRodríguez-Sinovas博士合作,验证这些抑制剂在心脏毒性模型中可能的治疗潜力。
